2023-01-03 | 科研部 南科大魏志毅团队揭示细胞内明星“快递员”分子-V型肌球蛋白的活性调控机制
近日,南方科技大学生命科学学院副教授魏志毅课题组在Science Advances上以“Autoinhibition and activation mechanisms revealed by the triangular-shaped structure of myosin Va”为题发表研究论文,揭示了细胞中一类广泛存在的运输型分子马达蛋白非对称的自抑制模式,提出了货物协同激活分子马达蛋白的机制。
在现实世界中,物流系统为人们的生活提供了必要的物质保障。在人体细胞中,也存在一套由分子马达蛋白作为运输载体,以细胞骨架作为运输轨道的物流体系,利用ATP水解产生的动力,输送各类生物活性物质到细胞内的功能区域。一旦此运输体系的调度发生紊乱,会引发神经退行性疾病、大脑发育迟缓、听力视力受损等一系列疾病。因此,对分子马达蛋白调控机制的研究,一直是细胞内物质运输领域研究的重中之重。
V型肌球蛋白(MyoV)是细胞内以微丝骨架为运输轨道的明星“快递员”分子,是细胞运送细胞器、囊泡、蛋白复合物、mRNA等生物组分的主要工具,也是胞内物质运输机理研究的模式分子之一。但由于其有较大分子尺寸且构象多变,过去长期以来的研究只能捕捉到MyoV的低分辨率结构或片段结构,难以全面地了解其活性调控机制。
魏志毅所领导的研究团队通过尝试多种表达条件后,成功拿到MyoV和钙调蛋白(CaM)的高质量复合物样品。经过一系列冷冻制样条件的筛选,最终解析了其近原子分辨率的冷冻电镜三维结构(图1)。该复合物整体包含2条MyoVa重链和12条CaM轻链分子。每条重链的头部包含一个可以水解ATP的马达结构域(MD),中间包含一段被6个CaM分子缠绕的用来调整步幅的杠杆臂区域(LA)和一段二聚化的卷曲螺旋区(CC),尾部结构域(GTD)则主要负责货物的识别和结合。其杠杆臂和卷曲螺旋区域之间能够形成一个铰链结构,使得其尾部结构域能够折回来与头部区域相互作用,从而抑制头部水解ATP的能力,最终形成一个类似等腰三角形的结构,抑制货物转运。有趣的是,卷曲螺旋区只结合在二聚化的尾部结构域的其中之一,从而将三角形结构分成了不同性质的左右两边,形成非对称的自抑制构象。
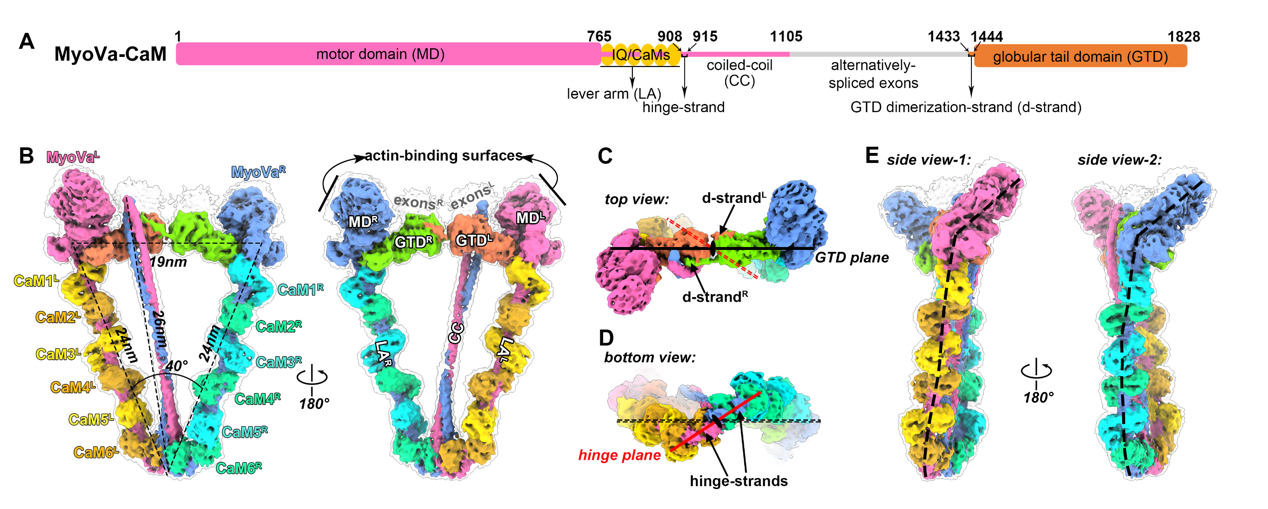
图1. MyoVa-CaM 复合物的冷冻电镜结构
研究人员进一步发现,卷曲螺旋和尾部结构域的非对称性结合,防止了无效货物(仅含有单一货物适配分子)对于MyoV的激活。只有在多种货物适配分子存在的情况下,这些货物适配分子协同破坏多个自抑制构象的稳定作用界面,使得MyoV可以被高效激活。基于结构研究以及生化和细胞实验验证,研究人员提出了MyoV响应货物的活性调控机制(图2)。在自抑制状态,MyoV分子形成相对稳定的三角形结构,头尾结合从而抑制行走所需的ATP酶活性;非对称性的自抑制构象使右边MyoV头尾之间的弱结合发生部分解离,处于半抑制状态;当正确货物到来,协同破坏效应导致右边MyoV的头部和杠杆臂进一步解离,进而破坏铰链结构,使得整个MyoV复合物无法继续稳定在自抑制状态;最终,三角形结构被完全打开,MyoV重新具备ATP水解能力和行走能力,开始在微丝轨道上运输货物。这一成果与该研究团队2020年的研究发现(Niuetal.Science Advances, 2020)共同揭示了V型肌球蛋白完整的工作循环机制,也为阐明分子马达超家族中其他为数众多的成员的活性调控机制奠定了基础。
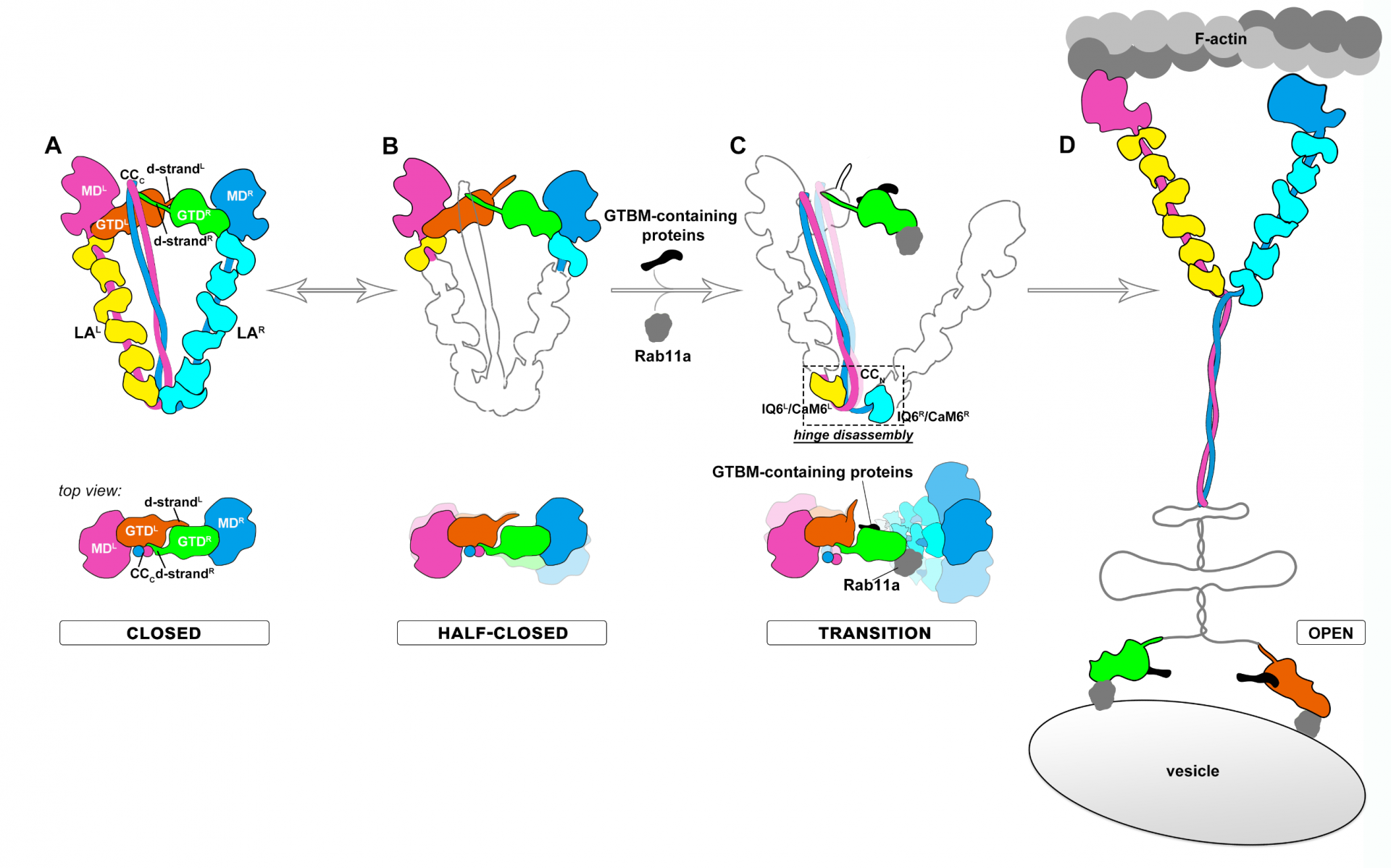
图2. MyoVa在多种货物协同作用下从自抑制状态转换为激活状态并开始货物运输的分子模型
魏志毅课题组的研究助理教授牛锋锋,博士研究生刘永和科研助理孙康是论文共同第一作者。魏志毅和牛锋锋为本文的共同通讯作者,南科大为论文的唯一通讯单位。生命科学学院副教授余聪和助理教授闫凯歌也参与了部分研究工作。本项研究得到了国家自然科学基金、深圳市科创委、深港脑科学创新研究院、南方科技大学冷冻电镜中心和分析测试中心的资金或技术支持。
论文链接:https://www.science.org/doi/10.1126/sciadv.add4187
供稿:生命科学学院
通讯员:付文卿
主图:丘妍
编辑:朱增光